Cavidad y medios bucales:
– Múltiples funciones: comunicación, alimentación, digestión, deglución, defensa, masticación, de relación.
– Abundante flora microbiana: Descubrimos nuevas especies. Interacción con los materiales que ponemos en la boca
– Presencia de saliva: Solvente, lubricante, conductora, buffer, antimicrobiana. Sin ella la boca estaría inflamada e infectada.
– Fuerzas:
– Funcionales: masticación, deglución (fuerzas axiales, paraaxiales)
– Parafunciones: comerse las uñas (los dientes trabajan para funciones para las que no están diseñados).
– Ciclos de humedad – desecación
– Cambios térmicos
– Los materiales, en general, soportan mal los cambios térmicos.
– Cambios químicos
– Cambios en la acidez/pH
– Capacidad de absorción
Cavidad y medios bucales: Las partes del diente y las mucosas no se comportan igual, puesto que no son iguales.
– Esmalte: En el esmalte hay una composición de cristales apretados; la dureza es diferente en distintas zonas.
– Dentina
– Ligamento
– Mucosa
– Hueso
– Cemento
Por infección, traumatismo se puede dar una pérdida de una parte del cuerpo por amputación o extirpación; ya sea una parte del diente o la mandíbula interna; para reponerlo se realiza la sustitución tisular mediante un implante o un trasplante.
– Implante: material ajeno al cuerpo (fabricado fuera) colocado para reponer lo que falta. Conceptualmente, implante es un tornillo y el material de obturación aunque coloquialmente se use para denominar sólo al tornillo.
– Trasplante: coger un tejido humano o no humano y colocarlo.
Si no es suficiente o inadecuado se realiza la regeneración tisular: se crea nuevamente aquello que se perdió (regeneración del tejido). Ej: hueso, encía… ápices en endodoncia… . Aún no está al cien por cien la regeneración de los dientes.
– Biocompatible:
✓ Definición: Aquello que no hace daño (es inerte) y promueve una reacción positiva/beneficiosa en el organismo.
✓ Materiales que causan daños (0’1 %de los casos) como toxicidad sistémica, reacciones locales, reacciones alérgicas, mutagenicidad, carcinogenicidad, o teratogenia etc.
– Compatible con otros materiales.
– Cualidades organolépticas aceptables:
● Olor, sabor, color, textura… aceptables.
– Que no decolore ni pigmente.
– Que pueda elaborarse en la forma deseada.
– Que tenga exactitud y precisión para cada indicación:
● En la odontología se maneja la micra (10-6)
– Resistencia mecánica específica y adecuada
– Resistencia a cambios físico-químicos y bioquímicos
– Que puedan producirse superficies adecuadas.
– Radiopacidad:
– A la hora de hacer una radiografía o buscarlos se sea capaz de encontrarlo. ‘Que salga blanco en la radiografía, que se puedan ver’
– Que se pueda limpiar y/o esterilizar
– Buenas condiciones de almacenamiento
– Costo razonable
NOTA*: Se pueden dar problemas de compatibilidad entre 2 materiales distintos
El material ideal es el natural , ningún material es perfecto. Esto quiere decir que todos tienen alguna carencia: las características que le faltan a unas las tienen otras y viceversa.
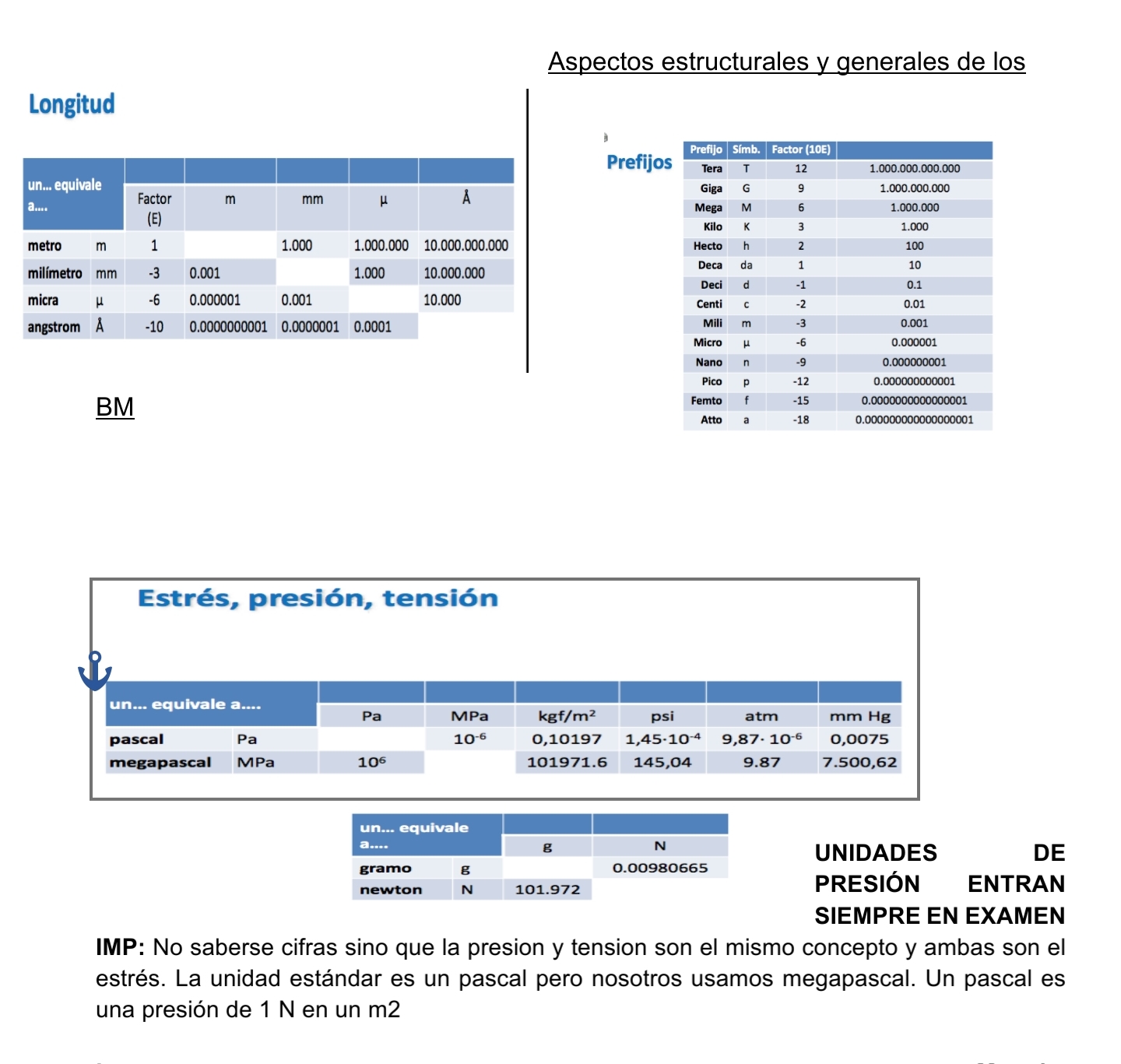
La Materia:
– Tiene dimensiones: Número de grados de libertad para realizar un movimiento en el espacio (medidas que definen su forma y su tamaño).
– Presenta inercia: Resistencia que opone un sistema (físico, social) a los cambios, o la capacidad de los cuerpos a seguir a seguir en su estado de movimiento. Resistencia al cambio, física, mental o social.
– Es la causa de la gravedad. Es un efecto de la geometría. La tierra deforma el espacio-tiempo de nuestro entorno, de manera que el propio espacio nos empuja hacia el suelo.
MATERIA: es todo lo que tiene masa. Puede presentarse de 2 maneras:
Mezcla de cosas:
– Composición variable
– Los componentes conservan sus principales características
– Pueden separarse en sustancias puras
– Entre ambas se requiere un cambio físico.
– 2 tipos:
■ Homogéneas (en todas sus partes es igual) componentes indistinguibles
■ Heterogénea (según donde mires la composición es diferente) Componentes distinguibles
Sustancia pura:
– Composición fija
– No pueden separarse en sustancias puras más simples por métodos físicos
– 2 tipos:
– Compuestos (por ejemplo uno de plata-cobre)
– Elementos (no pueden descomponerse en sustancias más sencillas como ocurre con la plata)
NOTA*: Puedes separar la mezcla en sustancias puras. Una vez tienes una sustancia pura no cambia, es como es. Pero una mezcla sí puede tener varias maneras.
Elementos:
– Entre los elementos metálicos ocurren enlaces metálicos
– Entre los covalentes, enlaces covalentes
– Y entre los elementos que están justo en la zona entre en la tabla, se producen enlaces iónicos
Abundancia de los elementos en el universo: El hidrógeno y el helio son los más abundantes (creados en el big bang).
Potencial de ionización: Es lo que cuesta que ese elemento reaccione.
Esquemas de tipos de refuerzos de materiales compuestos
Todos los materiales compuesto tiene una base que es una matriz y luego un añadido que hace que se diferencien.
1. Efecto Tyndall: La luz que reciben las partículas se desvía de la trayectoria inicial y estas se hacen visibles. Por ejemplo cuando ves el aire, la humedad. Por este efecto el cielo se percibe azul.
2. El movimiento browniano: Movimiento aleatorio que se observa en algunas partículas microscópicas que se hallan en un medio fluido Drunkward’s walk. Se llama así porque los movimientos que realizan las partículas parecen aleatorios, como un borracho. Sí que vibra (como todo, excepto las sustancias en el cero absoluto) en una dirección algo difusa.
Cuando el soluto es suficientemente pequeño no se deposita porque no le dejan, porque le están golpeando/bombardeando todo el rato.
Mezclas:
Tres tipos de mezclas:
– Homogéneas (disoluciones): El soluto se dispersa homogéneamente en el solvente, a nivel molecular: No se pueden distinguir sus componentes a simple vista. No tiene efecto Tyndall. Son opacas. Son estables porque son tan pequeñas que la gravedad ejerce efectos mínimos.
– Coloidales: Tamaño de partícula intermedio. Relativamente grandes (dispersan la luz, aunque no se vean) y suficientemente pequeñas: no se depositan fácilmente. La luz cuando atraviesa una mezcla coloidal, choca contra las partículas y se refleja. No se ven las partículas en si, sino el reflejo. Son grandes, pero no lo suficiente para sedimentarse, no se llegan a depositar. Si tiene efecto Tyndall. Si (casi no) son transparentes.
– Heterogéneas (suspensiones): Las partículas son tan grandes que a veces incluso se ven. Se deposita. Mucha veces ves el soluto a simple vista. No tiene efecto Tyndall. Son transparentes.Solo estas se pueden filtrar sus partículas.
DISOLUCIONES
Solubilidad: es la máxima cantidad de un material que se disolverá en una cantidad dada de disolvente, a una temperatura dada, para producir una disolución estable. Depende del soluto y del disolvente, no es lo mismo azúcar en agua, que miel en agua.
– D. saturada : aquella en la cual has disuelto todo lo que se puede disolver
– D. insaturada: la cantidad de soluto es menor que la máxima.
– D. sobresaturada: la cantidad de soluto es mayor que la máxima.
*El proceso de disolución será tanto más fácil cuanto mayor sean:
– El desprendimiento de calor→ un aumento de temperatura favorece la solubilidad si el proceso es endotérmico, pero la dificulta si es exotérmico.
– La velocidad de disolución de un sólido aumenta si se muelen los cristales grandes, se agita la disolución o se aumenta la temperatura.
Estados de agregación de la materia
LOS LÍQUIDOS
– Fluido cuyo volumen es constante en condiciones de temperatura y presión constantes y su forma es esférica→ son INCOMPRESIBLES
– Presentan tensión superficial y capilaridad
– Generalmente se expanden cuando se calientan y comprimen cuando se enfrían
– Los objetos inmersos en algún líquido son sujetos a un fenómeno conocido como flotabilidad
– Sus moléculas ocupan posiciones al azar que varían con el tiempo. Las distancias intermoleculares son constantes dentro de un estrecho margen.
– Cuando soprepasa su punto de ebullicion cambia a gas
– Tienen viscosidad, que es la resistencia que ejerce un líquido a fluir libremente.
Principio de Arquímedes:
El principio de Arquímedes afirma que todo cuerpo sumergido en un fluido experimenta un empuje vertical y hacia arriba igual al peso de fluido desalojado.
LOS GASES
– No tienen ni forma ni volumen propios → son moléculas no unidas, expandidas y con poca fuerza de atracción
– Son comprimibles.
– Ocupan todo el volumen del recipiente que los contiene.
LOS SÓLIDOS
– Elasticidad: recupera su forma original cuando es deformado.
– Fragilidad: puede romperse en muchos pedazos SIN DEFORMARSE (quebradizo)
– Dureza: es duro cuando no puede ser rayado por otro más blando El diamante es un sólido con dureza elevada. Es la dureza a ser rayado/penetrado por un pincho.
– Forma definida: son relativamente rígidos y no fluyen como lo hacen los gases y los líquidos, excepto a bajas presiones extremas. Se deforman pero de una manera lenta.
– Volumen definido : forma definida → volumen constante.
– Alta densidad
– Tenacidad: resistencia que opone un material a que se propaguen fisuras o grietas y por lo tanto que se rompa. EXAMEN.
– Maleabilidad: posibilidad de los cuerpos de ser labrados por deformación. La maleabilidad permite la obtención de desgadas láminas de material sin que este se rompa, teniendo en común que no existe ningún método para cuantificarlas
– Ductilidad: propiedad de los sólidos de poder obtener hilos de ellos.
Cambios de estado:
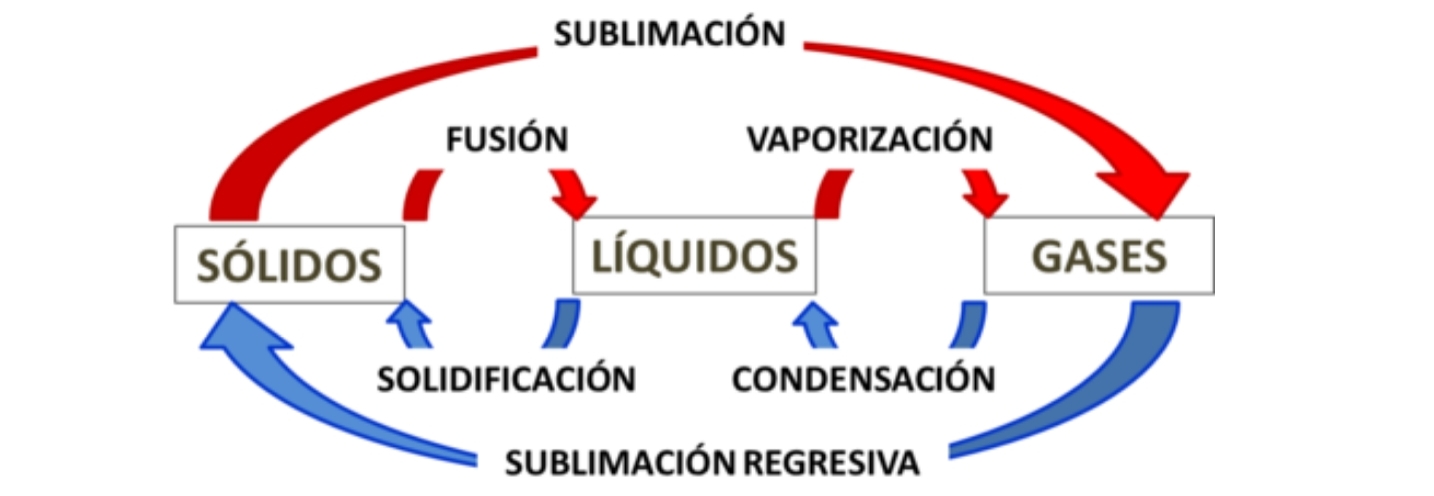
CRISTALIZACIÓN
Definición de CRISTAL: es una repetición periódica tridimensional de bloques o unidades, todos con la misma orientación (dentro de un sólido).
La cristalización se produce a partir de la incorporación de las sustancias que intervienen en un fluido.
Fases de la cristalización: nucleación, crecimiento.
Modos de cristalización :
– Precipitación: cuando el fluido es un sólido. Se verifica en todos los ambientes. Por…
- – Pérdida por evaporación del fluido (MÁS COMÚN)
– Aumentos en la concentración (aporte de iones)
– Variaciones de temperatura y presión. (Modificamos el movimiento de los materiales).
– Sublimación: cuando el fluido es un gas. Se produce la cristalización directamente al estado sólido.
Recristalización: Cuando por algún proceso los cristales que había se han perdido y se vuelven a formar dándose una reorganización interna de los componentes de un cristal preexistente.
*Al variar las condiciones del medio bien sea presión, temperatura o composición, un cristal puede desestabilizarse y empezar a variar su estructura o su composición por difusión en estado sólido.
¿Que sólidos son cristales?
IMPORTANTE: EN LOS POLÍMEROS NO HAY CRISTALES PERO HAY PARTES QUE SE COMPORTAN COMO TAL → Cristalinos.
Hay polímeros que como son muy ordenados porque se colocan todos igual tienden a formar cosas parecidas a cristales y les da un comportamiento como si fuera cristalino: Esto es la tacticidad ( disposición estereoquímica). Cuanto más ordenado o mayor tacticidad más cristalino:
– Isotácticos. Frecuentemente cristalinos. 100% de compuestos meso, favorecen la organización helicoidal. Están todos alineados.
– Sindiotácticos: Luego hay unos intermedios que a veces forman cristales. Posiblemente forman cristales. Está ordenado de forma poco conveniente
– Atácticos: Los desordenados tienden a ser amorfos, no forman cristales.
TIPOS DE SÓLIDOS SEGÚN SU CRISTALIZACIÓN:
MATERIALES CRISTALINOS:
– Sus átomos se unen entre sí siguiendo en un patrón definido en todo el material.
– Orden de largo alcance, como al colocar ladrillos para formar una pared.
– El patrón de ordenamiento es repetitivo y regular.
MATERIALES AMORFOS:
– Los átomos se une a otros sin seguir un orden o patrón definido.
– Sus moléculas se distribuyen al azar
– Sus propiedades físicas son idénticas en todas las direcciones
– Se funden a diferentes temperaturas
– Desorden total: No hay cristales. Esto ocurre en muchas cerámicas y la mayoría de los polímeros.
– Son traslúcidos, dejan pasar un poco de luz.
SEMICRISTALINO O SEMIAMORFO:
– Partes cristalinas (átomos ordenados) y partes desordenadas
– Orden de corto alcance.
– Los metales son de estos dos tipos porque son cristalinos.
– Las cerámicas son un material muy peculiar, hay muchos tipos y algunas de ellas sí tienen cristales.
Sólidos reales: Defectos de los cristales
Nunca hay perfección
– Si falta uno hay una vacancia
– Puedo meter un átomo intersticial
– O que uno sustituya a otro: átomo sustitucional
Fronteras de granos→ Es donde cambian los átomos de dirección y es donde empiezan normalmente las fracturas ya que tienen características peores. .Separa dos zonas de cristales perfectos pero diferentes.
Este cristal va a tener un comportamiento diferente al perfecto porque habrá zonas que se comporten diferente, y precisamente en esos puntos donde hay una imperfección de algún tipo es donde se produce el comienzo de la fractura. Las cosas se rompen porque son imperfectas.
Tipos de defectos:
– Lineales → dislocaciones
– Puntuales
– De superficie→ fronteras de granos
Burbujas y porosidades
– Medida (en porcentajes) de espacios vacíos en el seno de un material
– El hecho de que la materia tenga porosidades es muy importante, porque no se comporta igual una materia con o sin poros.
– La porosidad es algo que no podemos evitar prácticamente nunca, siempre que se manipula un material la naturaleza se las ingenia para meter dentro aire. Por lo que esa idea de los cristales perfectos no existe. La materia es imperfecta.
Defectos de superficie
Los defectos de superficie están siempre presentes, ya que las uniones de los cristales son siempre defectuosas. En los sólidos reales además de estos efectos hay poros.
Los defectos de superficie tienen efectos sobre:
– Propiedades ópticas:
– Inmediatas (un cristal malo)
– Retardadas (tinciones), los poros del cristal malo se tiñen y la masa cambia de color
– Propiedades mecánicas
– Cambios dimensionales, en un material perfecto sin poros los cambios dimensionales al enfriarlo o calentarlo no van a ser los mismos que en uno con poros.
– Propiedades biológicas, los poros acaban siendo asiento de microorganismos, de sustancias que se han lixiviado… se forman zonas de colonización.
NOTA*: Toda fractura comienza en un defecto




